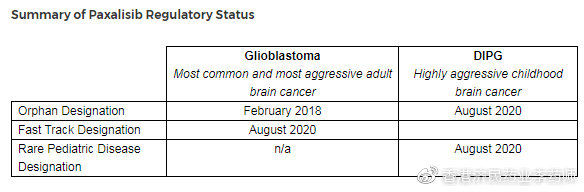
Kazia Therapeutics公司近日宣布,美國食品和藥物管理局(FDA)已授予paxalisib(原GDC-0084)治療膠質母細胞瘤(glioblastoma)的快速通道資格(FTD),具體為:新診斷的、O6-甲基鳥嘌呤-DNA甲基轉移酶(MGMT)基因啟動子呈非甲基化狀態、已完成初步放療和替莫唑胺治療的患者。在2018年2月,FDA還授予了paxalisib治療膠質母細胞瘤的孤兒藥資格(ODD)。
此外,在上周末,FDA還授予了paxalisib治療惡性膠質瘤的孤兒藥資格(ODD),包括DIPG。而在本月早些時候,FDA還授予了paxalisib治療DIPG的罕見兒科疾病資格(RPDD)。DIPG是一種罕見和高度侵襲性的兒童惡性腫瘤,極度缺乏有效治療手段、致死率極高。目前,paxalisib治療DIPG的一項I期研究正在St Jude兒童研究醫院進行,初步療效數據預計2020年下半年獲得。
paxalisib是Kazia的先導候選藥物,這是一種能穿過血腦屏障的PI3K/AKT/mTOR通路小分子抑制劑,于2016年底從羅氏旗下基因泰克獲得授權,于2018年進入II期臨床試驗。
膠質母細胞瘤是原發性腦癌中最常見、最具侵襲性的一種類型。此次FTD的目標患者準確地反映了paxalisib正在進行的II期臨床研究中所研究的患者群體,是GBM AGILE關鍵研究的主要建議人群,也是商業發布時的預期適應癥。
膠質瘤
在美國,FTD的設立旨在加速針對嚴重疾病的藥物開發和快速審查,以解決關鍵領域嚴重未獲滿足的臨床醫療需求。paxalisib獲得FTD,意味著有機會以各種形式的加快審評進程,包括在研發階段可以與FDA進行更頻繁的會晤與溝通;在滿足相關標準的情況下,實行滾動式審評機制,即可分階段遞交新藥申請(NDA)申報資料,而不需要待所有資料全部完成后再提交審評;FTD的授予也有望進一步獲得優先審評和加速批準資格。
FDA授予paxalisib FTD,意味著該機構已認識到該藥有潛力顯著改善膠質母細胞瘤患者的預后,這是一個非常有力的認可。Kazia公司已計劃在2021財年開始啟動paxalisib新藥申請(NDA)提交的準備事宜。
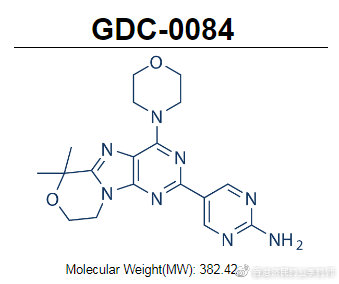
paxalisib-GDC-0084化學結構式
今年4月初,Kazia公司公布了正在進行的評估paxalisib治療膠質母細胞瘤(GBM)II期研究(NCT03522298)的陽性中期數據。該研究在新診斷的、非甲基化MGMT啟動子狀態的GBM患者中開展,正在評估患者接受最大限度手術切除和替莫唑胺(temozolomide,TMZ)聯合同步放化療后,將paxalisib作為輔助治療藥物的安全性、耐受性、推薦的II期劑量(RP2D)、藥代動力學(PK)和臨床活性。TMZ是目前治療GBM的標準護理療法。
結果顯示:
(1)paxalisib輔助治療的中位總生存期(OS)為17.7個月,與現有標準護理TMZ相關的12.7個月相比,代表著臨床意義的生命延長。
(2)paxalisib輔助治療的中位無進展生存期(PFS)為8.5個月,與現有標準護理TMZ相關的5.3個月相比,代表著有利結果。
(3)接受治療時間最長的患者,在確診后19個月仍保持疾病無進展。
(4)大約一半的入組患者,仍然在接受paxalisib治療,隨著研究的繼續推進,OS和PFS數據可能進一步改善。

該研究的進一步數據預計將在2020財年下半年公布,最終數據預計將在2021財年上半年公布。對于任何新的抗癌藥物而言,“金標準”都是延長生命的能力——在膠質母細胞瘤(GBM)等疾病中,這是一個特別具有挑戰性的目標。這些新數據提供了第一份臨床證據,證明paxalisib有潛力在一個非常具有挑戰性的患者群體中實現這一目標。
二十多年來,新診斷的膠質母細胞瘤患者沒有任何新的藥物治療。paxalisib正在迅速成為這一極具挑戰性疾病全球管線中最有希望的候選藥物之一。
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962
