Oncopeptipes AB公司近日宣布,美國食品和藥物管理局(FDA)已受理其提交的新藥申請(NDA)并授予了優先審查,該NDA尋求批準melflufen(melphalanflufenamide)聯合地塞米松治療三重難治性多發性骨髓瘤(MM)成人患者。三重難治是指患者疾病對至少一種蛋白酶體抑制劑、一種免疫調節劑、一種抗CD38單抗治療無效。
FDA已指定處方藥用戶收費法(PDUFA)目標日期為2021年2月28日。優先審查意味著FDA的目標是在6個月內對NDA完成審查并做出審查決定;相比之下,標準的審查周期為10個月。
此次NDA,基于關鍵II期HORIZON研究的結果。該研究評估了靜脈melflufen聯合地塞米松治療復發性難治性多發性骨髓瘤(RRMM)的療效。研究共入組了157例患者,這些患者在免疫調節劑(IMiD)和蛋白酶體抑制劑(PI)治療失敗后,對泊馬度胺(pomalidomide)和/或Darzalex(daratumumab,達雷妥尤單抗)不敏感。該研究的患者人群包括三重難治和/或髓外疾病和/或具有細胞遺傳學高危特征的患者亞組。
數據顯示:
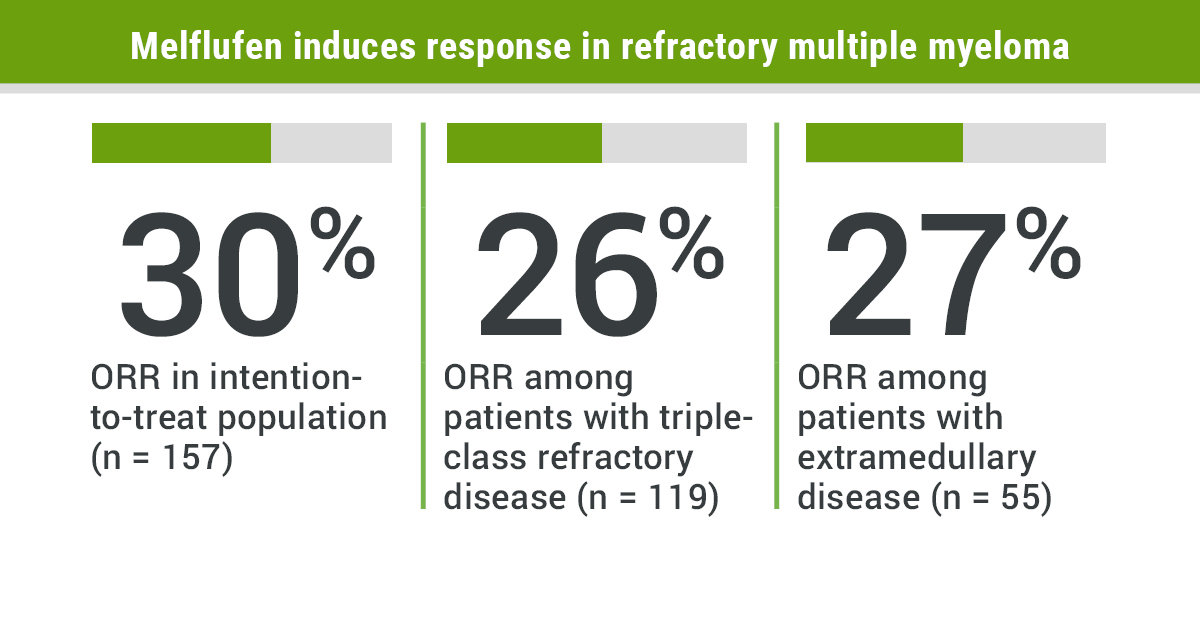
(1)在意向性治療(ITT,n=157)群體中,總緩解率(ORR)為29%、中位無進展生存期(PFS)為4.2個月、中位總生存期(OS)為11.6個月;在有治療應答的患者中,中位緩解持續時間(DOR)為5.5個月、中位PFS為8.5個月。
(2)在三重難治亞組(n=119)中,ORR為26%、中位PFS為3.9個月、中位OS為11.2個月;在有治療應答的患者中,中位DOR為4.4個月、中位PFS為8.5個月。
(3)在髓外疾病(EMD,n=55)亞組中,ORR為24%、中位PFS為2.9個月、中位OS為6.5個月;在有治療應答的患者中,中位DOR為5.5個月、中位PFS為17.3個月。所有這些數據都得到了獨立審查委員會(IRC)的確認。
結果顯示:melflufen聯合地塞米松方案,有潛力為難以治療且預后很差的RRMM患者提供一種治療選擇,包括三重難治性骨髓瘤患者和髓外疾病(EMD)患者。該研究中,melflufen+地塞米松方案治療顯示出持久緩解、且隨著治療時間的延長而加深,這表明患者能夠從長期治療中獲益。
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962
