近日,ADC Therapeutics SA公司宣布,已向美國食品和藥物管理局(FDA)提交了loncastuximab tesirine(Lonca,前稱ADCT-402)的生物制品許可申請(BLA),該藥用于治療復發性或難治性彌漫性大B細胞淋巴瘤(DLBCL)。
loncastuximab tesirine(Lonca)是一種靶向CD19的ADC療法,由一種人源化抗人CD19單克隆抗體通過連接器與吡咯并苯并二氮雜卓(pyrrolobenzodiazepine,PBD)二聚體細胞毒素偶聯而成。一旦與表達CD19的細胞結合,Lonca就會被細胞內化,隨后釋放出細胞毒素,該毒素能不可逆地與DNA結合,從而產生阻止DNA鏈分離的強力鏈間交聯,從而破壞復制等必要的DNA代謝過程,最終導致細胞死亡。CD19是一個經驗證的治療B細胞惡性腫瘤的熱門靶點。
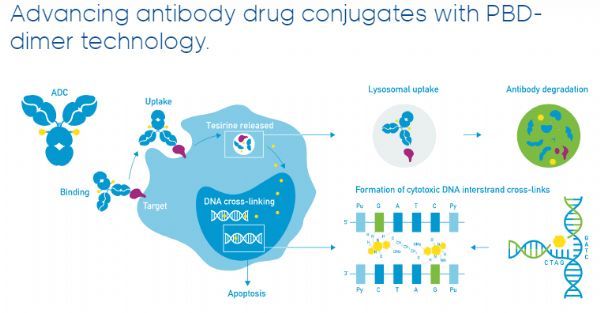
抗體藥物偶聯物-PBD二聚體技術
Lonca BLA的提交,基于來自關鍵2期LOTIS 2研究的數據。這是一項多中心、開放標簽、單臂臨床試驗,評估了Lonca治療先前接受過至少2種系統療法的復發或難治性DLBCL患者的療效和安全性。2020年6月,該公司在第25屆歐洲血液學會(EHA)虛擬會議上公布了來自LOTIS 2的成熟數據:截止2020年4月6日數據截止日期,共145例患者入組研究,這些患者先前接受的系統療法中位數為3種。
結果顯示,Lonca的客觀緩解率(ORR)為48.3%(70/145例)、完全緩解率(CR)為24.1%(35/145例)。研究中,Lonca的耐受性總體上是可控的,發生在≥10%患者中的最常見≥3級治療期間出現的不良事件(TEAE)為:中性粒細胞減少癥(25.5%)、發熱性中性粒細胞減少癥(3.4%)、血小板減少癥(17.9%)、GGT升高(16.6%)和貧血(10.3%)。
該公司還啟動了LOTIS 5,這是Lonca與利妥昔單抗聯合應用的驗證性3期臨床試驗,旨在支持一項補充BLA,將Lonca作為治療復發或難治性DLBCL的二線療法。
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962
