羅氏(Roche)近日宣布,歐洲藥品管理局(EMA)人用醫藥產品委員會(CHMP)已發布一份積極審查意見,建議批準抗PD-L1療法Tecentriq(泰圣奇,通用名:atezolizumab,阿替利珠單抗)聯合Avastin(安維汀,通用名:bevacizumab,貝伐珠單抗),用于治療既往未接受過系統治療的不可切除性或轉移性肝細胞癌(HCC)成人患者。現在,CHMP的意見將遞交至歐盟委員會(EC)審查,后者通常會在2個月內做出最終審查決定。
在美國監管方面,Tecentriq+Avastin組合于今年5月獲得FDA批準,用于治療既往未接受過系統治療的不可切除性或轉移性HCC患者。該適應癥是在FDA的實時腫瘤學審查(RTOR)試點項目Orbis倡議下審查并批準的。就在最近,Tecentriq+Avastin組合還被歐洲腫瘤醫學協會(ESMO)推薦作為治療不可切除性HCC的I類藥物,同時也被全球許多臨床實踐指南所采納。在中國,該方案已于今年1月獲國家藥品監督管理局(NMPA)受理、于2月底被授予優先審評資格。
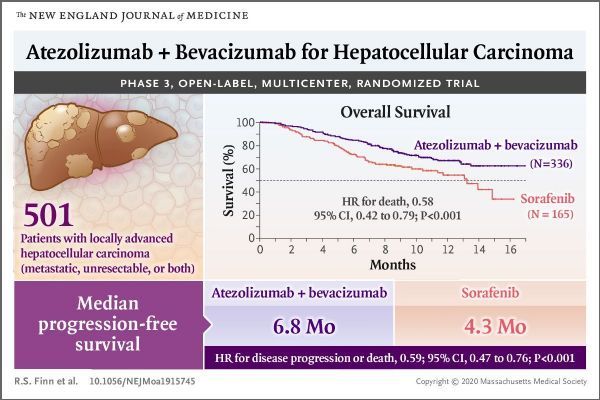
Tecentriq+Avastin組合是第一個也是唯一一個被批準用于治療不可切除性或轉移性HCC的癌癥免疫治療方案。來自IMbrave150臨床試驗的數據顯示,與標準護理藥物索拉非尼(sorafenib)相比,Tecentriq+Avastin聯合治療顯著延長了總生存期(OS)和無進展生存期(PFS)。
IMbrave150是在最常見的肝癌治療中顯示出改善OS和PFS的首個III期癌癥免疫治療研究。Tecentriq與Avastin組合也是十多年來在先前未接受系統治療的不可切除性肝細胞癌患者中改善總生存期的首個治療方案。
IMbrave150(NCT03434379)是一項開放標簽、多中心、隨機III期研究,在先前未接受系統治療的不可切除性、局部晚期或轉移性HCC患者中開展,調查了Tecentriq與Avastin聯合治療方案相對于標準護理藥物——多激酶抑制劑索拉非尼(sorafenib)的療效和安全性。研究中,患者以2:1的比例隨機分配,接受Tecentriq+Avastin聯合治療(n=336)或索拉非尼治療(n=165),直至出現不可接受的毒性反應或失去臨床受益。該研究的共同主要終點是由獨立評估機構根據實體瘤療效評價標準1.1版(RECIST 1.1)確定的總生存期(OS)和無進展生存期(PFS)。
結果顯示:與索拉非尼組相比,Tecentriq+Avastin聯合治療組總生存期顯著延長(中位OS:NE vs 13.2個月)、死亡風險降低42%(HR=0.58,95%CI:0.42-0.79,p=0.0006)、12個月生存率提高(67.2% vs 54.6%)。此外,與索拉非尼組相比,Tecentriq+Avastin聯合治療組疾病無進展生存期顯著延長(中位PFS:6.8個月 vs 4.3個月)、疾病進展或死亡風險降低41%(HR=0.59,95%CI:0.47-0.76,p<0.0001)。
該研究中,Tecentriq+Avastin聯合治療組有38%的患者出現嚴重不良反應(3-4級),最常見的(>2%)是胃腸道出血、感染和發熱。這些結果已于今年5月發表于國際頂級醫學期刊《新英格蘭醫學雜志》(NEJM)。
原文出處:Roche receives positive CHMP opinion for Tecentriq in combination with Avastin for the treatment of people with the most common form of liver cancer
(責任編輯:香港祺昌藥業)
聯系祺昌
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962