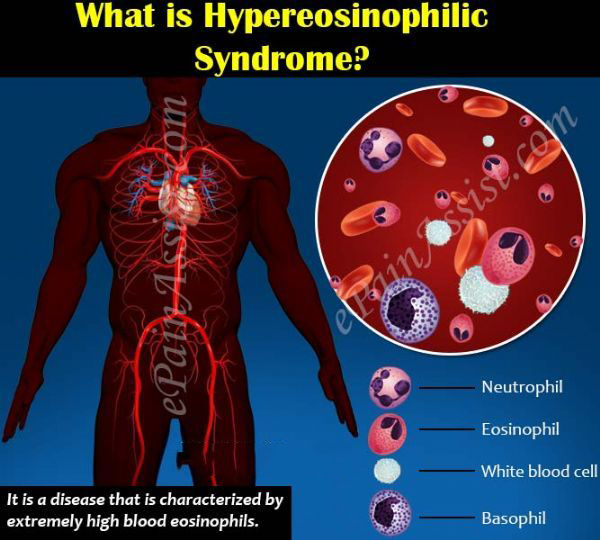
??葛蘭素史克(GSK)近日宣布,美國食品和藥物管理局(FDA)已批準抗炎藥Nucala(mepolizumab,美泊利單抗)一個新的適應癥,用于治療高嗜酸性粒細胞綜合征(HES)患者,具體為:HES持續≥6個月、無可識別的非血液學次要原因、年齡≥12歲的成人和兒科患者。HES是一種罕見的、危及生命的、由嗜酸性炎癥引起的疾病,治療方案非常有限。
值得一提的是,Nucala是第一個也是唯一一個被批準用于治療這種嗜酸性粒細胞驅動疾病的靶向生物療法,將改變HES患者的治療格局。而HES也是Eucala獲批的第三個適應癥,該藥之前已被批準:作為一種附加維持療法,用于治療重度嗜酸性粒細胞性哮喘(SEA)、嗜酸粒細胞性肉芽腫性多血管炎(EGPA)。
此次批準,基于關鍵III期臨床研究(NCT02836496)的陽性結果。這是一項隨機、雙盲、安慰劑對照、36周研究,評估了Nucala用于青少年和成人治療重度HES的療效和安全性。重度HES定義為:過去12個月內至少出現兩次HES耀斑、血液嗜酸性粒細胞計數≥1000個細胞/微升。研究中,共有108例患者被隨機分配,接受每四周一次皮下注射Nucala 300mg(3x100)或相匹配的安慰劑,同時繼續接受其當前的HES療法。研究的主要終點是32周治療期間經歷一次HES耀斑的患者比例,次要終點包括:發生首次HES耀斑的時間(定義為隨機化開始至出現HES耀斑的時間)、治療第20-32周期間經歷一次HES耀斑的患者比例、HES耀斑年化率、根據簡易疲勞量表(BFI)第三項評估的疲勞嚴重程度相對基線的變化。
結果顯示,該研究達到了主要終點:聯合標準護理治療32周期間,與安慰劑組相比,Nucala治療組發生一次HES耀斑的患者比例顯著減少50%(56% vs 28%,p=0.002)。研究的次要終點也具有統計學意義,并支持主要終點結果,數據顯示:治療32周期間,與安慰劑組相比,Nucala治療組發生首次HES耀斑的風險降低了66%(危險比[HR]=0.34,95%CI:0.18-0.67)、HES耀斑年化率降低了66%(發生率比值比[RR]=0.34,95%CI:0.19-0.63)、疲勞評分表現出改善(p=0.036)。該研究中的安全性結果與Nucala已知的安全性一致。
Nucala
Nucala被認為是通過降低血液中嗜酸性粒細胞水平而起作用的,有證據表明,該藥有可能成為一系列由嗜酸性粒細胞增多引起的炎性疾病的靶向治療選擇。來自上述關鍵III期研究的數據非常令人鼓舞,為HES患者帶來了希望。
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962
