再生元(Regeneron)近日宣布,美國食品和藥物管理局(FDA)已批準Inmazeb(atoltivimab、maftivimab、odesivimab-ebgn,前稱REGN-EB3),該藥是一款三抗體雞尾酒療法,用于治療由扎伊爾型埃博拉病毒(Zaireebolavirus)引起的感染,該藥可用于成人和兒童感染者,包括感染檢測呈陽性母親的新生兒。
值得一提的是,Inmazeb是美國FDA批準的第一個用于治療埃博拉病毒感染的藥物。Inmazeb是由3種全人IgG1單抗組成的混合物,由再生元利用專有的VelociSuite®快速反應技術開發,目前該技術正被應用于開發針對新型冠狀病毒肺炎(COVID-19)的新型抗體雞尾酒療法。
埃博拉病毒是導致埃博拉出血熱(EHF)的元兇,該病是一種急性病毒性傳染病,癥狀包括發燒、頭痛、關節和肌肉疼痛、乏力、腹瀉、嘔吐、胃痛、食欲不振及異常出血。在美國和歐盟,REGN-EB3均被授予了孤兒藥資格、在美國被授予了突破性藥物資格(BTD)。除了REGN-EB3之外,來自Ridgeback Biotherapeutics的一款治療埃博拉病毒感染的單克隆抗體mAb114也在美國和歐盟被授予孤兒藥資格、BTD、優先藥物資格(PRIME)。
Inmazeb的安全性和有效性在PALM(Pamoja Tulinde Maisha,共同拯救生命)試驗中得到了證實。
從2018年11月20日至2019年8月9日,PALM研究總共入組了681例患者。研究中,這些患者以1:1:1:1的比例接受4種療法的治療,包括3種抗體療法(抗體雞尾酒ZMapp、三抗雞尾酒療法Inmazeb、治療性單抗mAb114)和一款抗病毒藥物remdesivir(瑞德西韋),其中ZMapp用作對照。研究中,所有藥物均靜脈輸注:(1)ZMapp治療組,從第1天開始每3天接受50mg/kg體重的劑量,共3次;(2)remdesivir治療組,第1天接受負荷劑量(成人200mg,兒童根據體重調整)、從第2天開始每日維持劑量(成人100mg),持續9-13天(具體取決于病毒載量);(3)MAb114治療組,接受50mg/kg劑量,在第1天作為單次輸液;(4)Inmazeb治療組,在第1天接受150mg/kg單次輸液。研究的主要終點是治療28天的死亡率。
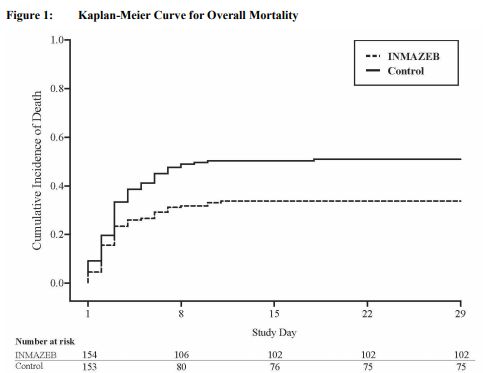
結果顯示:接受Inmazeb和mAb114治療的受試者比其他兩組受試者有更大的生存機會。治療28天的具體數據為:(1)ZMapp、remdesivir、mAb114、Inmazeb治療組感染者死亡率分別為49.7%(84/169)、53.1%(93/175)、35.1%(61/174)、33.5%(52/155);(2)在感染后早期治療且血液病毒水平較低的患者中,數據更強,死亡率分別為:24.5%(24/98)、29.0%(29/100)、9.9%(10/101)、11.2%(10/89)。
整個埃博拉疫情的死亡率約為67%。基于上述數據,PALM研究已提前終止,并選擇Inmazeb和mAb114作為擴展期中用于所有未來患者隨機治療的藥物。在PALM研究中,共有154例患者接受了Inmazeb治療,在擴大獲取項目中,另有284例患者接受了Inmazeb治療。在接受Inmazeb治療的患者中,經歷的最常見不良事件是:發燒、發冷、心動過速(心率過快)、呼吸急促(呼吸急促)和嘔吐;然而,這些也是埃博拉病毒感染的常見癥狀。接受Inmazeb治療的患者應避免同時使用活疫苗,因為該療法有可能抑制用于預防埃博拉病毒感染的活疫苗病毒的復制,并可能降低疫苗的效力。
(責任編輯:香港祺昌藥業)
聯系祺昌
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962