Blenrep(belantamab mafodotin)注射劑說明書
2020年8月5日,美國食品藥品監督管理局(FDA)批準了葛蘭素史克(GSK)公司的Blenrep(belantamab mafodotin,GSK2857916)上市。該藥是一種靶向B細胞成熟抗原(BCMA)的抗體藥物偶聯物(ADC),作為一種單藥療法,用于治療先前已接受過至少4種療法、且其疾病對至少一種蛋白酶體抑制劑/免疫調節劑/CD38單抗難治、在最后一次治療中被證明疾病進展的復發或難治性多發性骨髓瘤(R/R MM)成人患者。
葛蘭素史克 GSK 公司生產的Blenrep圖冊
【生產企業】:葛蘭素史克 GSK
【規格】:100mg/瓶
【商標】:BLENREP
【通用名】:belantamab mafodotin-blmf for injection
【英文名稱】:BLENREP (belantamab mafodotin-blmf) for injection, for intravenous use
【貯藏】:冷藏于2°C至8°C
【Blenrep(belantamab mafodotin)注射劑適應癥】
BLENREP用于成人復發性或難治性多發性骨髓瘤的治療,這些患者以前至少接受過4種治療,包括抗CD38單克隆抗體、蛋白酶體抑制劑和免疫調節劑。
根據腫瘤緩解率數據,該適應癥通過加速審批程序獲得批準。針對該適應癥的持續批準,將取決于驗證性試驗中臨床益處的驗證和描述。
【Blenrep(belantamab mafodotin)注射劑劑量和給藥方法】
1.重要安全信息
在Blenrep治療開始前和治療期間進行眼科檢查
除非有眼科醫生指導,建議患者使用不含防腐劑的眼藥水并且避免佩戴隱形眼鏡。
2.推薦劑量
BLENREP的推薦劑量為2.5mg/kg,每3周一次,靜脈輸注約30分鐘,直到疾病進展或出現不可接受的毒性。
3.不良反應的劑量調整
不良反應的推薦劑量為1.9 mg/kg靜脈滴注,每3周一次
不能耐受1.9 mg/kg劑量的患者停止使用BLENREP
4.角膜不良反應的劑量調整
|
|
角膜不良反應 |
推薦劑量 |
|
1級 |
角膜檢查結果:輕度淺表性角膜病變
最佳矯正視力(BCVA)改變:Snellen視覺敏銳度下降1行 |
按當前劑量繼續治療。 |
|
2級 |
角膜檢查結果:中度淺表性角膜病變
BCVA變化:Snellen視力下降2或3行且不低于20/200 |
停止使用BLENREP直至角膜檢查結果均得到改善,并且BCVA變為1級或更高,并以相同劑量恢復。 |
|
3級 |
角膜檢查結果:嚴重的淺表性角膜病變
BCVA的變化: Snellen視力比基線下降3行以上且不低于20/200 |
暫停使用BLENREP直至角膜檢查結果均得到改善,并且BCVA更改為1級或更高,并以減少的劑量恢復。 |
|
4級 |
角膜檢查結果:角膜上皮缺損
BCVA變化:Snellen視力低于20/200 |
考慮永久停用BLENREP。如果繼續治療,則暫不使用BLENREP,直到兩個角膜檢查結果均得到改善,并且BCVA變為1級或更高,并以減少的劑量恢復。 |
輕度淺表角膜病:有癥狀或無癥狀的輕度淺表性角膜病變(有記錄在案的視力變化)
BCVA改變:與治療相關的角膜病變引起的視力變化
中度淺表性角膜病變:有或沒有斑塊狀的微囊樣沉積物,眼睛上皮下混濁或新的周圍基質不透明。
嚴重的淺表性角膜病變,伴有或不伴有彌散性微囊樣沉積物,眼睛上皮下混濁新的中央基質混濁。
角膜上皮缺損:例如角膜潰瘍 |
5.其他不良反應的劑量調整
|
不良反應 |
嚴重程度 |
推薦劑量 |
|
血小板減少癥 |
血小板計數25,000至小于50,000 / mcL |
考慮停用BLENREP和/或減少BLENREP的劑量。 |
|
血小板計數低于25,000 / mcL |
暫停使用BLENREP,直到血小板計數提高到3級或更高。考慮以減少的劑量恢復。 |
|
輸液相關反應 |
2級(中等)或3級(嚴重) |
中斷輸液并提供支持治療。癥狀緩解后,以較低的輸注速度恢復;將輸注速度降低至少50%。 |
|
四級(危及生命) |
永久停止使用BLENREP并提供緊急護理。 |
|
其他不良反應 |
3級 |
暫停使用BLENREP,直到達到1級或更高。考慮以減少的劑量恢復。 |
|
|
4級 |
考慮永久停用BLENREP。如果繼續治療,則暫不使用BLENREP直至改善至1級或更高,然后以減少的劑量恢復。 |
【Blenrep(belantamab mafodotin)注射劑給藥配制】
BLENREP是一種危險的藥物。遵循適用的特殊處理和處置程序。
根據患者的實際體重計算所需溶液的劑量(Mg)、總體積(ML)和所需的BLENREP小瓶數量。一次劑量可能需要1瓶以上。不要舍去小瓶的劑量。
一、重構
1. 從冰箱中取出BLENREP小瓶,靜置約10分鐘以達到室溫(20°C至25°C)。
2. 用2 mL無菌注射用水重構每個100 mg的BLENREP小瓶,使最終濃度為50 mg / mL。輕輕旋轉小瓶以幫助溶解。不要搖晃。
3. 如果不立即使用重構溶液,請在2°C至8°C下冷藏保存或在室溫(20°C至25°C)中最多放置4個小時。如果未在4小時內使用,請丟棄溶液。不要凍結。
4. 在給藥前應目視檢藥品是否有顆粒物質和變色。重構后的溶液應透明至乳白色,無色至黃色至棕色液體。如果發現異物,則丟棄。
二、稀釋
從適當數量的小瓶中取出計算出的BLENREP的體積,并在含有250 mL的0.9%氯化鈉注射液輸液袋中稀釋至0.2 mg / mL至2 mg / mL的最終濃度。輸液袋必須由聚氯乙烯(PVC)或聚烯烴(PO)制成。
輕輕顛倒混合稀釋后的溶液。不要搖晃。
丟棄小瓶中殘留的任何未使用的BLENREP重構溶液。
如果不立即使用稀釋的輸液,請在2°C至8°C的溫度下冷藏保存至多24小時。不要凍結。從冰箱中取出后,請在6小時內(包括輸注時間)使用BLENREP的稀釋輸注溶液。
在給藥前應目視檢藥品是否有顆粒物質和變色。稀釋后的輸注溶液應透明無色。如果發現有顆粒物,則丟棄。
三、使用
如果冷藏,請在給藥前將稀釋的輸注溶液放置至室溫(20°C至25°C)。稀釋的輸注溶液可以在室溫下保存不超過6小時(包括輸注時間)。
使用聚氯乙烯(PVC)或聚烯烴(PO)制成的輸液器,在大約30分鐘內通過靜脈輸液進行給藥。
無需過濾稀釋溶液;如果要將稀釋的溶液過濾,請使用聚醚砜(PES)過濾器(0.2微米)。
請勿將BLENREP與其他產品混合或混用。該產品不含防腐劑。
【Blenrep(belantamab mafodotin)注射劑的警告和注意事項】
1. 眼部毒性:可能會出現角膜病、視力改變等情況。建議患者每天至少使用4次不含防腐劑的眼藥水。從第一次輸液開始,一直持續到治療結束。除非得到眼科醫生的指導,否則不要使用隱形眼鏡。視力的改變可能影響駕駛和閱讀,建議病人在駕駛或操作機器時要小心。BLENREP僅通過REMS下的受限計劃提供。
2. BLENREP REMS:由于眼部毒性的風險,BLENREP只能通過稱為BLENREP REMS的REMS下的受限計劃獲得。
3. 血細胞計數減少。根據臨床指示在基線和治療期間進行完整的血細胞計數檢查。根據嚴重程度考慮停藥和/或減少劑量
4. 輸液相關反應:監測患者輸液相關反應。對于2級或3級反應,請中斷輸液并提供支持治療。癥狀緩解后,以較低的輸注速率恢復。之后在注射之前使用相應藥物以減少不良反應發生。如果輸液相關反應危及生命,立即停止使用并提供適當的緊急護理。
5. 胎兒毒性:根據其作用機制,BLENREP在給孕婦使用時會造成胎兒傷害,因為它含有一種遺傳毒性化合物(微管抑制劑,單甲基金黃色F[MMAF]),而且它的靶標是活躍的分裂細胞。建議孕婦注意胎兒的潛在危險。勸告有生育潛力的女性在BLENREP治療期間以及最后一次用藥后的4個月內使用有效的避孕方法。建議具有生殖潛能的女性伴侶的男性在BLENREP治療期間以及最后一次給藥后的6個月內使用有效的避孕藥
【Blenrep(belantamab mafodotin)注射劑藥物過量】
暫無有關信息
【Blenrep(belantamab mafodotin)注射劑禁忌癥】
無
【Blenrep(belantamab mafodotin)注射劑不良反應】
最常見的不良反應(≥20%)是角膜病變(眼睛檢查時角膜上皮細胞改變)、視力下降、惡心、視力模糊、發熱、輸液相關反應和疲勞。
最常見的3級或4級實驗室異常(≥5%)是血小板減少、淋巴細胞減少、血紅蛋白減少、中性粒細胞減少、肌酐升高和γ-谷氨酰轉移酶升高。
【Blenrep(belantamab mafodotin)注射劑在特殊人群中使用】
孕婦:BLENREP可能會造成胎兒傷害,在使用BLENREP治療期間和末次劑量后4個月內使用有效的避孕措施。
哺乳期:勸告婦女在使用BLENREP治療期間以及最終劑量后至少3個月內不要母乳喂養
兒童:在兒科患者中安全性和有效性尚未確定。
【Blenrep(belantamab mafodotin)注射劑一般描述】
Belantamab mafodotin-blmf是一種B細胞成熟抗原(BCMA)導向的抗體和微管抑制劑結合物,由3個組分組成:1)糖基化的人源化免疫球蛋白G1單克隆抗體通過3)抗蛋白酶的馬來酰亞胺丙基連接物與2)微管抑制劑MMAF共價連接。該抗體是利用重組DNA技術在哺乳動物細胞系(中國倉鼠卵巢)中生產的,微管抑制劑和連接物是通過化學合成的。大約每個抗體分子上附著4個mafodotin分子。Belantamab mafodotin-blmf的分子量約為152 kDa。Belantamab mafodotin-blmf具有以下結構
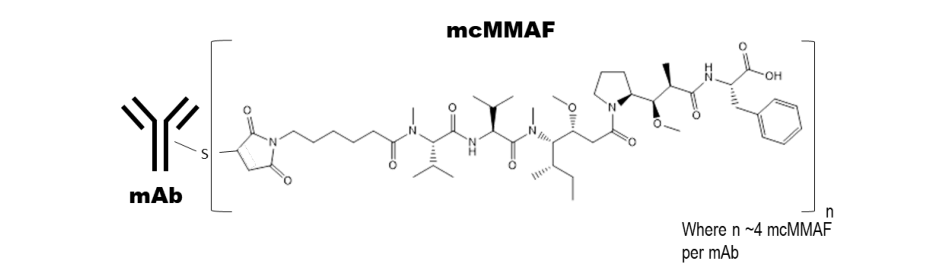
注射用BLENREP(belantamab mafodotin-blmf)是一種無菌、無防腐劑、白色到黃色的凍干粉,裝在單量劑瓶中,用于靜脈注射前的重新配置和進一步稀釋。BLENREP每瓶100mg,需要用2mL注射用無菌水重新配制,以獲得50mg/mL的濃度。每mL重組液含有Belantamab Mafodotin-BLMF(50 mg)和非活性成分檸檬酸(0.4 mg)、依地酸鈉(0.019 mg)、聚山梨酸酯80(0.2 mg)、二水海藻糖(75.6 mg)和二水檸檬酸鈉(6.7 mg)。重組溶液的pH值為6.2。
【Blenrep(belantamab mafodotin)注射劑作用機制】
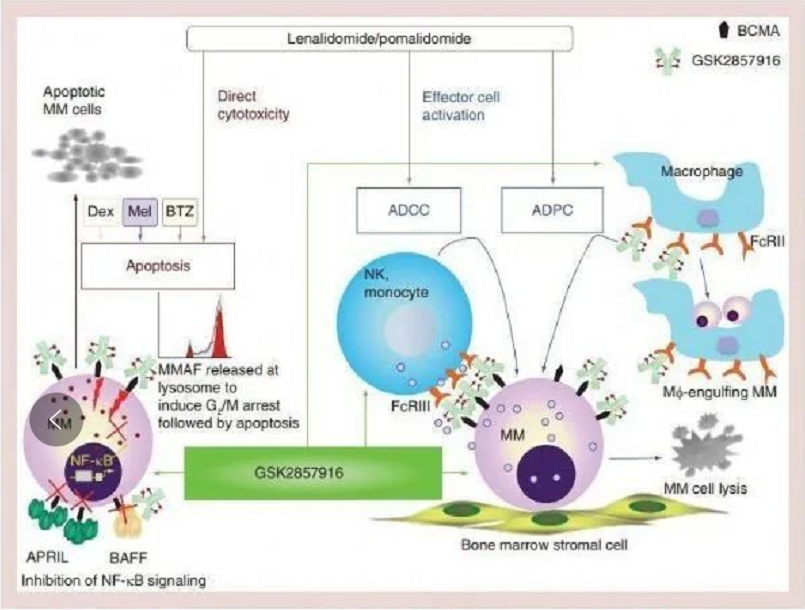
Belantamab mafodotin-blmf是一種抗體-藥物結合物(ADC)。抗體成分是針對BCMA(一種在正常B淋巴細胞和多發性骨髓瘤細胞上表達的蛋白)的糖基化IgG1。小分子成分是微管抑制劑MMAF。當與BCMA結合時,belantamab mafodotin-blmf被內化,然后通過蛋白水解釋放MMAF。釋放的MMAF在細胞內破壞微管網絡,導致細胞周期停滯和凋亡。Belantamab mafodotin-blmf對多發性骨髓瘤細胞具有抗腫瘤活性,可通過MMAF誘導的細胞凋亡、抗體依賴的細胞毒作用(ADCC)和抗體依賴的細胞吞噬作用(ADCP)介導對腫瘤細胞的殺傷作用。
【患者資訊資料】
1. 忠告患者出現以上任何不良反應(警告和注意事項)的癥狀立即聯系醫護人員。
2. BLENREP可能引起角膜上皮的變化,導致視力變化,包括嚴重的視力喪失和角膜潰瘍,以及癥狀,如視力模糊和干眼
3. 在每次給藥之前,在基線進行眼科檢查,并及時檢查是否有惡化的癥狀。根據嚴重程度暫停使用BLENREP直到病情好轉和恢復,或永久停止給藥。
4. 由于眼部毒性的風險,BLENREP只能在風險評估和緩解策略(REMS)下通過一項名為BLENREP REMS的受限計劃獲得。
5. 告知妊娠婦女和生殖潛能婦女,BLENREP可能會造成胎兒傷害,在使用BLENREP治療期間和末次劑量后4個月內使用有效的避孕措施。
6. 建議具有生殖潛能的女性伴侶的男性患者在接受BLENREP治療期間以及最終劑量后6個月內使用有效的避孕方法。
7. 告知哺乳期婦女在接受BLENREP治療期間及最終劑量后的3個月內不要母乳喂養。
8. 忠告患者應主動告知正在使用的其他任何藥物,包括處方藥、非處方藥等。
(責任編輯:香港祺昌藥業)
聯系祺昌
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962




