TG Therapeutics公司近日宣布,美國食品和藥物管理局(FDA)已授予ublituximab與umbralisib組合療法(U2)快速通道資格(FTD),用于治療慢性淋巴細胞白血病(CLL)成人患者。快速通道資格(FTD)旨在加速針對嚴重疾病的藥物開發和快速審查。
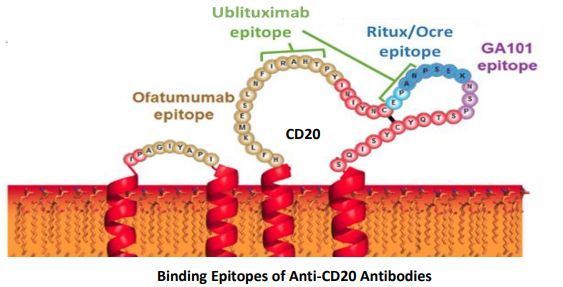
ublituximab則是一種新型糖工程化抗CD20單克隆抗體,靶向成熟B淋巴細胞上CD20抗原的一個獨特表位。umbralisib是一種口服、每日一次的、新一代PI3Kδ抑制劑,可獨特地抑制CK1-ε,這可能使其克服第一代PI3Kδ抑制劑相關的某些耐受性問題。
如果獲準上市,U2將為先前未接受過治療(初治)的CLL患者、以及對先前療法治療無效或復發的CLL患者提供一種新的、無化療方案。
FDA授予U2組合療法FTD,是基于全球III期UNITY-CLL試驗的陽性頂線結果。該試驗在先前未接受治療(初治)和復發/難治性(經治)慢性淋巴細胞白血病(CLL)患者中開展,評估了U2組合療法的療效和安全性,并與obinutuzumab+苯丁酸氮芥方案進行了對比。
該項試驗是根據與FDA達成的特別方案評估(SPA)協議開展的。結果顯示,該試驗在預先指定的中期分析中已經達到了主要終點:根據獨立審查委員會(IRC)的評估,與obinutuzumab+苯丁酸氮芥治療組相比,U2治療組無進展生存期(PFS)取得了統計學意義的顯著改善(p<0.0001),在既往未接受治療(初治)和復發/難治性(經治)CLL患者群體中均觀察到了治療益處。
根據該試驗的數據,TG公司計劃在2020年底之前提交U2方案治療先前未接受治療(初治)和復發/難治性(經治)CLL患者的監管申請。
(責任編輯:香港祺昌藥業)
聯系祺昌
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962