近日,ViiV Healthcare公司宣布,歐洲藥品管理局(EMA)人用醫藥產品委員會(CHMP)已發布一份積極審查意見,建議批準Rukobia(fostemsavir)600mg緩釋片,聯合其他抗逆轉錄病毒(ARV)藥物,用于治療無法構建抑制性抗病毒方案的多重耐藥HIV-1成人感染者。
Rukobia是一種治療HIV-1感染的新型附著抑制劑。今年6月,Rukobia獲得美國FDA批準,適應癥為:聯合其他ARV藥物,用于治療曾嘗試過多種HIV療法(heavily treatment-experienced,HTE)、并且由于耐藥/不耐受或安全性的考慮而對其當前ARV方案治療失敗的多重耐藥HIV-1成人感染者。
在關鍵III期BRIGHT研究中,大多數(60%)HTE多重耐藥HIV-1成人感染者接受Rukobia和優化的背景治療后,實現并維持病毒抑制直至96周,且CD4+T細胞技術有臨床意義的改善。
CHMP的積極審查意見,基于在HTE多重耐藥HIV患者中開展的關鍵III期BRIGHT研究(NCT02362503)的數據。該研究的96周結果于2019年7月在墨西哥城舉辦的2019國際艾滋病學會艾滋病科學會議(IAS 2019)上公布。
BRIGHT是一項2個隊列(隨機和非隨機)研究,評估了HIV-1附著抑制劑fostemsavir在既往已過度治療(HTE)的HIV-1成人感染者中的安全性和有效性。研究共入組了371例患者,這些患者盡管服用抗逆轉錄病毒(ARV)藥物但血液中的病毒(HIV-RNA)水平仍然很高。大多數患者接受HIV治療超過15年(71%)、在進入試驗前曾接受過5種或更多種不同的HIV治療方案(85%)和/或有艾滋病史(86%)。
所有患者均記錄有對目前可用的6類ARV藥物中的4類具有耐藥性、不可耐受性和/或禁忌癥。在隨機隊列(n=272)中,患者在基線時必須對1類但不超過2類ARV藥物保持完全活性,并且不能從其剩余的藥物中形成可行的ARV方案。這些患者以3:1的比例進行隨機分配,在其當前失敗的治療方案中盲法加入fostemsavir或安慰劑(n=272),進行持續8天的功能性單藥治療。針對已批準ARV無任何剩余完全活性的患者(n=99)被分配進入非隨機隊列,并在第1天接受開放標簽fostemsavir及優化的背景治療(OBT)。研究的主要終點是隨機隊列log10 HIV-1 RNA在第1天與第8天之間的平均變化。在8天雙盲期之后,隨機隊列所有患者接受開放標簽fostemsavir和優化的背景治療。關鍵的次要終點包括第24、48、96周反應的持久性,以及CD4+細胞技術從基線的安全變化和病毒耐藥性的出現。
結果顯示,根據隨機隊列中從第1天到第8天HIV-1 RNA經調整后的平均下降,主要終點分析顯示fostemsavir優于安慰劑(分別下降0.79和0.17 log10 c/mL;p<0.0001,意向性治療-暴露[ITT-E]人群)。在隨機隊列中,在這種難以治療的多藥耐藥HIV-1患者群體中,病毒學抑制和免疫應答率從24周至96周繼續增加。
具體數據:隨機隊列中接受fostemsavir與優化背景療法(OBT)治療的患者中,治療第24、48周、96周實現病毒學抑制(HIV-1 RNA<40拷貝/毫升[c/ml])的患者比例分別為53%、54%、60%(n=163/272)。隨時間推移,患者表現出持續的免疫改善,CD4+細胞計數的平均變化持續增加(第24周、48周、96周分別增加90個、139個、205個細胞/微升)
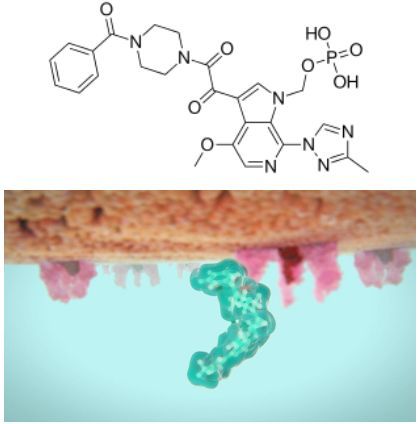 fostemsavir分子結構式
fostemsavir分子結構式
研究中,最常見的不良反應(≥5%,所有級別)是惡心和腹瀉。至第96周,因不良事件而停止fostemsavir治療的患者比例為7%(隨機:5%,非隨機:2%)。
Rukobia的批準上市,將為那些由于各種原因而無法用現有藥物抑制和維持病毒抑制的HTE多重耐藥HIV-1成人感染者,提供一個重要的治療選擇。此前,美國FDA已授予Rukobia快速通道資格、優先審查資格、突破性藥物資格。歐盟EMA已授予Rukobia加速評估資格。
(責任編輯:香港祺昌藥業)
聯系祺昌
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962