輝瑞公司(Pfizer)日前宣布,美國FDA已受理該公司為第三代ALK抑制劑勞拉替尼(lorlatinib,英文商品名:Lorbrena)遞交的補充新藥申請(sNDA),用于一線治療ALK陽性轉移性非小細胞肺癌(NSCLC)患者。FDA同時授予這一sNDA優先審評資格,并且正在使用實時腫瘤學審評(RTOR)試點項目中對其進行審評,預計在2021年4月前做出回復。
Lorbrena是一種酪氨酸激酶抑制劑(TKI),它在攜帶ALK重排的臨床前肺癌模型中顯示出高度活性。Lorbrena專門開發用于抑制對其他ALK抑制劑耐藥的ALK基因突變,并可穿透血腦屏障,治療腦轉移。高達40%的ALK陽性肺癌患者出現腦轉移。
肺癌是全世界癌癥相關死亡的首要原因之一。NSCLC約占肺癌的80-85%,ALK陽性腫瘤發生在約3-5%的NSCLC病例中。
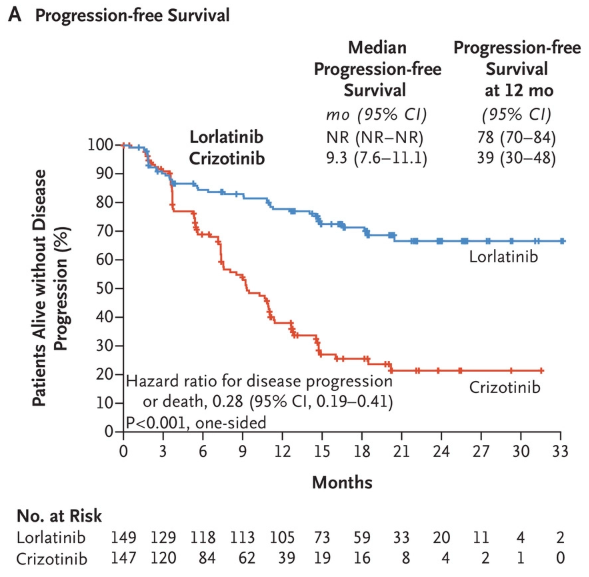
這一申請得到了3期臨床試驗CROWN的積極結果的支持。在今年11月發表在《新英格蘭醫學雜志》的中期分析結果顯示,與現有一線標準治療克唑替尼(crizotinib)相比,勞拉替尼將疾病進展或死亡風險降低72%(HR=0.28,95% CI:0.19-0.41,P<0.001)。克唑替尼組的中位無進展生存期(PFS)為9.3個月,勞拉替尼組中位PFS尚未達到。
勞拉替尼組(藍線)和克唑替尼組(紅線)患者的無進展生存情況
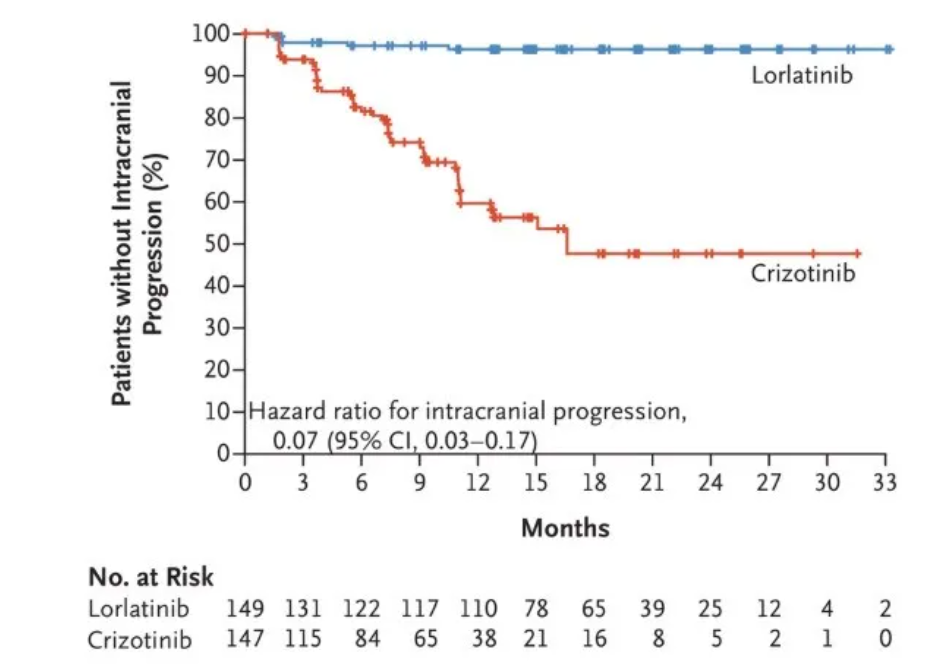
對于腦轉移的預防和緩解,勞拉替尼也表現出了顯著優勢。在12個月時,勞拉替尼組無顱內疾病進展的生存率為96%,而克唑替尼治療組這一比例為60%。勞拉替尼將顱內疾病進展或死亡的風險降低93%!
勞拉替尼組(藍線)和克唑替尼組(紅線)患者的顱內無進展生存情況
“FDA決定使用旨在加速審評過程的創新審評途徑評估勞拉替尼的監管申請,體現了它作為ALK陽性晚期非小細胞肺癌患者初始療法的潛力。”輝瑞全球產品開發部腫瘤學首席開發官Chris Boshoff博士說,“我們期待與FDA合作,盡快為患者帶來這一治療選擇。”
(責任編輯:香港祺昌藥業)
聯系祺昌
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962