2021年2月24日,艾伯維宣布,美國FDA批準Humira(阿達木單抗,商品名:修美樂)用于治療5歲及以上兒童中度至重度活動性潰瘍性結腸炎(UC)。
此次批準是基于關鍵的3期臨床研究ENVISION I的結果。該研究表明,Humira在第8周達到了部分Mayo評分(PMS)臨床緩解的共同主要終點,在第8周有反應的患者中,在一年(52周)達到了完全Mayo評分(FMS)臨床緩解的共同主要終點。臨床緩解被定義為PMS或FMS小于或等于2,且個體得分不大于1。
ENVISION I是一項隨機、雙盲、多中心3期研究,旨在評估Humira在中重度UC患兒(年齡4-17歲)中的療效、安全性和藥代動力學(定義為FMS為6-12,內窺鏡檢查得分為2-3分,經中央閱讀內窺鏡檢查證實),皮下注射。
到第8周,兩個劑量組的患者在第0周服用Humira 2.4 mg/kg(最大160 mg),第2周服用1.2 mg/kg(最大80 mg),第4周和第6周服用0.6 mg/kg(最大40 mg)。高劑量組在第1周還接受了2.4 mg/kg(最大160 mg)的額外劑量。在第8周和第52周之間,患者每隔一周或每周接受雙盲安慰劑,Humira 0.6 mg/kg(最多40 mg)。該研究的共同主要終點是在第8周時每經前綜合癥的臨床緩解率(定義為經前綜合癥≤2分且無個體分項評分>1),以及在第52周時每經前綜合癥達到臨床緩解率(定義為Mayo評分≤2分且無個體分項評分>1)患者Mayo評分的臨床緩解率(定義為Mayo評分≤2分且無個體分項評分>1分)。
研究結果顯示,在8周誘導期結束時,服用高劑量Humira的患者中,有60%的患者(28/47)在每次經前綜合癥時獲得臨床緩解,而服用低劑量Humira的患者中,有43%的患者(13/30)獲得臨床緩解。在第52周,在第8周的PMS應答者中,接受高劑量Humira治療的患者中,45%的患者在每次FMS中病情緩解,接受低劑量Humira治療的患者中,有29%的患者病情緩解,隨機接受安慰劑治療的患者中,有33%的患者病情緩解。由于樣本量小,安慰劑數據的可解釋性受到限制。
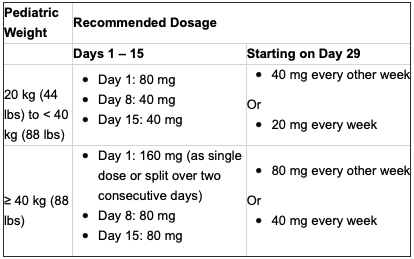
Humira的批準劑量將根據兒童的體重確定,如下:
對于年滿18歲的患者,以及對其Humira治療方案控制良好的患者,建議繼續使用推薦的兒科劑量。
在ENVISION I研究中,沒有觀察到Humira的新安全信號。在該研究中的任何Humira暴露期間,22.6%的患者經歷了嚴重的不良事件。誘導期和維持期最常報告的(大于或等于5%)因治療引起的不良事件是頭痛和潰瘍性結腸炎惡化。本研究未觀察到死亡、惡性腫瘤、活動性肺結核或脫髓鞘疾病。
(責任編輯:香港祺昌藥業)
聯系祺昌
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962