基石藥業合作伙伴Blueprint Medicines近日宣布,已向美國食品和藥物管理局(FDA)提交了pralsetinib的新藥申請(NDA),用于治療晚期或轉移性RET突變甲狀腺髓樣癌(MTC)患者和RET融合陽性甲狀腺癌患者。注:pralsetinib由Blueprint Medicines設計,這是一種口服、強效、高選擇性的RET融合和突變(包括預測的耐藥突變)抑制劑。
此次新藥申請(NDA),通過實時腫瘤學審查試點項目(RTOR項目)提交。這是FDA腫瘤卓越中心推出的一項倡議,旨在探索一種更有效的審查程序,以確保患者盡快獲得安全有效的治療藥物,同時保持和提高FDA的審查質量。
今年5月,pralsetinib治療局部晚期或轉移性RET融合陽性非小細胞肺癌(NSCLC)的新藥申請(NDA)和營銷授權申請(MAA)分別被FDA和歐洲藥品管理局(EMA)受理。
Blueprint Medicines首席醫學官Andy Boral表示:“preliminary具有廣泛的潛力來滿足攜帶RET基因改變的癌癥患者的醫療需求,盡管其腫瘤有已知的疾病驅動因素,但在傳統上并沒有從靶向治療中獲益。目前,pralsetinib在RET改變的非小細胞肺癌和甲狀腺癌的上市申請正在接受審查。我們正與監管機構密切合作,盡快為患者提供這種有希望的治療藥物。”
轉染期間重排(RET)基因是一個在轉染過程中發生重排的原癌基因,并因此而得名,該基因編碼一種細胞膜受體酪氨酸激酶RET,其異常是多種類型腫瘤的罕見驅動因素。
RET激活型融合和突變是許多癌癥類型的關鍵疾病驅動因素,包括NSCLC和MTC。RET融合涉及約1-2%的NSCLC患者、約10-20%的甲狀腺乳頭狀癌(PTC)患者,而RET突變牽涉到約90%的晚期MTC患者。此外,在結直腸癌、乳腺癌、胰腺癌和其他癌癥中,也觀察到低頻率的RET改變,在耐藥、EGFR突變的NSCLC患者中也觀察到RET融合。
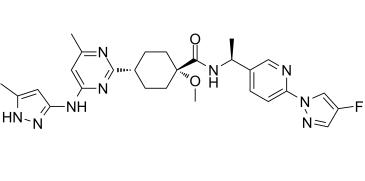
pralsetinib分子結構式(圖片來源:medchemexpress.com)
pralsetinib是一種口服(每日一次)、高效和高選擇性的靶向致癌性RET變異的精準藥物。Blueprint Medicines正在進行pralsetinib的臨床開發,用于治療RET變異的非小細胞肺癌、甲狀腺髓樣癌和其他實體瘤患者。在美國,FDA已授予pralsetinib突破性療法認定,用于治療經含鉑化療進展的RET融合NSCLC、和需要系統治療且沒有可替代治療方案的RET突變甲狀腺髓樣癌(MTC)患者的治療。
pralsetinib是由Blueprint Medicines的研究團隊依據其專有化合物文庫所設計的。在臨床前研究中,pralsetinib針對最常見RET基因融合、激活突變和耐藥突變始終表現出次納摩爾水平的效價。此外,pralsetinib對RET的選擇性與已批準的多激酶抑制劑相比有顯著提高,其中,對RET有效性與VEGFR2相比有超過90倍的提高。通過抑制原發和繼發突變,pralsetinib有望克服和預防臨床耐藥性的發生。這種治療方法預期可以在攜帶不同RET變異的患者中實現持久的臨床緩解,且具有良好的安全性。
(責任編輯:香港祺昌藥業)
聯系祺昌
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962