ViiV Healthcare是一家由葛蘭素史克(GSK)控股、輝瑞(Pfizer)和鹽野義(Shionogi)持股的HIV/AIDS藥物研發公司。近日,該公司宣布,美國食品和藥物管理局(FDA)已批準Rukobia(fostemsavir)600mg緩釋片,該藥是一種治療HIV-1感染的新型附著抑制劑,適用于:聯合其他抗逆轉錄病毒(ARV)藥物,用于治療曾嘗試過多種HIV療法(heavily treatment-experienced,HTE)、并且由于耐藥/不耐受或安全性的考慮而對其當前ARV方案治療失敗的多重耐藥HIV-1成人感染者。
此次批準,基于在HTE多重耐藥HIV患者中開展的關鍵III期BRIGHT研究(NCT02362503)的數據。該研究的96周結果于2019年7月在墨西哥城舉辦的2019國際艾滋病學會艾滋病科學會議(IAS 2019)上公布。
BRIGHT是一項2個隊列(隨機和非隨機)研究,評估了HIV-1附著抑制劑fostemsavir在既往已過度治療(HTE)的HIV-1成人感染者中的安全性和有效性。研究共入組了371例患者,這些患者盡管服用抗逆轉錄病毒(ARV)藥物但血液中的病毒(HIV-RNA)水平仍然很高。大多數患者接受HIV治療超過15年(71%)、在進入試驗前曾接受過5種或更多種不同的HIV治療方案(85%)和/或有艾滋病史(86%)。
所有患者均記錄有對目前可用的6類ARV藥物中的4類具有耐藥性、不可耐受性和/或禁忌癥。在隨機隊列(n=272)中,患者在基線時必須對1類但不超過2類ARV藥物保持完全活性,并且不能從其剩余的藥物中形成可行的ARV方案。這些患者以3:1的比例進行隨機分配,在其當前失敗的治療方案中盲法加入fostemsavir或安慰劑(n=272),進行持續8天的功能性單藥治療。針對已批準ARV無任何剩余完全活性的患者(n=99)被分配進入非隨機隊列,并在第1天接受開放標簽fostemsavir及優化的背景治療(OBT)。研究的主要終點是隨機隊列log10 HIV-1 RNA在第1天與第8天之間的平均變化。在8天雙盲期之后,隨機隊列所有患者接受開放標簽fostemsavir和優化的背景治療。關鍵的次要終點包括第24、48、96周反應的持久性,以及CD4+細胞技術從基線的安全變化和病毒耐藥性的出現。
結果顯示,根據隨機隊列中從第1天到第8天HIV-1 RNA經調整后的平均下降,主要終點分析顯示fostemsavir優于安慰劑(分別下降0.79和0.17 log10 c/mL;p<0.0001,意向性治療-暴露[ITT-E]人群)。在隨機隊列中,在這種難以治療的多藥耐藥HIV-1患者群體中,病毒學抑制和免疫應答率從24周至96周繼續增加。
具體數據:隨機隊列中接受fostemsavir與優化背景療法(OBT)治療的患者中,治療第24、48周、96周實現病毒學抑制(HIV-1 RNA<40拷貝/毫升[c/ml])的患者比例分別為53%、54%、60%(n=163/272)。隨時間推移,患者表現出持續的免疫改善,CD4+細胞計數的平均變化持續增加(第24周、48周、96周分別增加90個、139個、205個細胞/微升)
研究中,最常見的不良反應(≥5%,所有級別)是惡心和腹瀉。至第96周,因不良事件而停止fostemsavir治療的患者比例為7%(隨機:5%,非隨機:2%)。
在關鍵III期研究中,大多數(60%)HTE多重耐藥HIV-1成人感染者接受Rukobia和優化的背景治療后,實現并維持病毒抑制直至96周。Rukobia將解決HIV領域一個關鍵的未滿足醫療需求。
Rukobia的批準上市,將為那些由于各種原因而無法用其他藥物抑制病毒的HTE多重耐藥HIV-1成人感染者,提供一個重要的治療選擇。此前,FDA已授予fostemsavir快速通道資格、優先審查資格、突破性藥物資格。目前,該藥也正在接受歐洲藥品管理局(EMA)的加速評估。
Rukobia的活性藥物成分為fostemsavir,這是一種首創的(first-in-class)HIV-1附著抑制劑。fostemsavir是temsavir的一種前藥,通過口服后,fostemsavir可轉變為temsavir,然后被吸收并通過直接附著在病毒表面糖蛋白120(gp120)亞基發揮抗病毒作用。通過與病毒上的這個位置結合,temsavir可阻止HIV病毒附著到宿主免疫系統CD4+T細胞和其他免疫細胞上,并防止HIV病毒感染這些細胞并增殖。由于Rukobia是第一個針對病毒周期中第一步(附著)的抗逆轉錄病毒療法,因此對其他種類的抗逆轉錄病毒藥物沒有顯示出耐藥性,這可能幫助對大多數其他藥物產生耐藥性的HIV感染者。
在過去30年里,HIV治療方面取得了令人難以置信的進步。抗逆轉錄病毒藥物能夠有效抑制HIV,這有助于減少疾病進展、HIV傳播和與艾滋病有關的死亡,但由于HIV具有不斷變化的能力,一些患者可能對抗逆轉錄病毒藥物產生耐藥性,導致其治療方案失敗。在耐受性、安全性和藥物相互作用方面的挑戰,可能會進一步減少在設計有效治療方案時可接受的抗逆轉錄病毒療法的數量。對于既往接受過多種方案并且無法成功抑制HIV的多重耐藥患者群體而言,仍然存在著顯著未得到滿足的醫療需求。來自Rukobia臨床開發項目的療效和安全性研究結果表明,該藥對于需要新治療方案的多重耐藥HIV感染者具有獨特的潛力。Rukobia的批準上市,將提供一種全新的方法,來幫助這類患者實現對病毒的抑制。
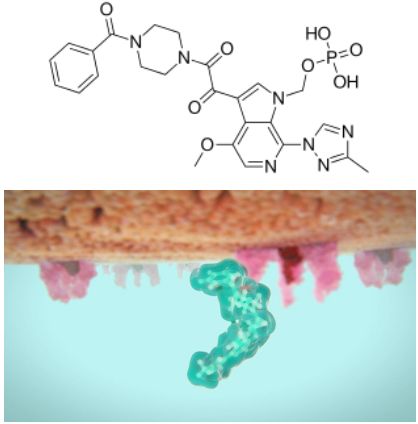
fostemsavir分子結構式(圖片來源:Wikipedia)
擴展閱讀:
過去幾十年來的重大進展極大地改善了HIV的治療,對許多患者來說,HIV被認為是一種可控的終生疾病。然而,由于耐藥、耐受性或安全性的考慮,HTE成人患者(約占HIV感染者的6%)幾乎沒有或沒有選擇余地,有AIDS病情進展和死亡的風險,迫切需要額外的治療方案。
(責任編輯:香港祺昌藥業)
聯系祺昌
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962



