葛蘭素史克(GSK)近日宣布,歐盟委員會(EC)已有條件批準Blenrep(belantamabmafodotin,GSK2857916),該藥是一種靶向B細胞成熟抗原(BCMA)的抗體藥物偶聯物(ADC),適應癥為:作為一種單藥療法,用于治療先前已接受過至少4種療法、且其疾病對至少一種蛋白酶體抑制劑/一種免疫調節劑/一種CD38單抗難治、在最后一次治療中被證明疾病進展的復發或難治性多發性骨髓瘤(R/R MM)成人患者。

今年8月初,Blenrep通過優先審查程序獲得了美國FDA的加速批準,適應癥與上述相同。根據腫瘤緩解率數據,該適應癥通過加速審批程序獲得批準。針對該適應癥的持續批準,將取決于驗證性試驗中臨床益處的驗證和描述。
值得一提的是,Blenrep是全球獲批的第一個BCMA靶向療法,這是一款首創(first-in-class)的人源化抗BCMA療法,適用于那些接受當前標準護理但病情進展的患者。Blenrep采用多方面的作用機制靶向BCMA,這是一種細胞表面蛋白,在漿細胞存活中起重要作用,并在多發性骨髓瘤細胞上表達。
此次批準,基于關鍵性性DREAMM-2研究的數據,包括13個月的隨訪數據。這是一項隨機、開放標簽、雙臂II期研究,共入組了196例既往過度治療的(heavily pretreated)R/R MM患者,這些患者盡管接受當前的標準治療但病情惡化、既往接受的治療方案中位數為7種、對免疫調節藥物和蛋白酶體抑制劑難治、并對抗CD38抗體難治和/或不耐受。研究中,患者被隨機分為兩組,接受每三周一次(Q3W)2.5mg/kg或3.4mg/kg劑量Blenrep治療。
研究數據顯示:Blenrep 2.5mg/kg Q3W單藥治療的總緩解率(ORR)為32%、中位緩解持續時間(DoR)為11個月、中位總生存期(OS)為13.7個月。安全性和耐受性與先前報道的Blenrep數據一致。2.5mg/kg組發生的最常見的不良反應(≥20%)為角膜病變/微囊樣上皮改變(MEC;71%)、血小板減少癥(38%)、貧血(27%)、視力模糊事件(25%)、惡心(25%)、發熱(23%)、天冬氨酸轉氨酶(AST)升高(21%)、輸液相關反應(21%)、淋巴細胞減少癥(20%)。
對于接受當前可用的標準護理療法但疾病仍在進展的R/R MM患者,治療選擇非常有限,預后也很差。DREAMM-2研究的最新隨訪結果進一步證明了Blenrep的潛力。該藥的批準上市,將為這些患者提供一個重要的新治療選擇,幫助解決重大未滿足醫療需求。
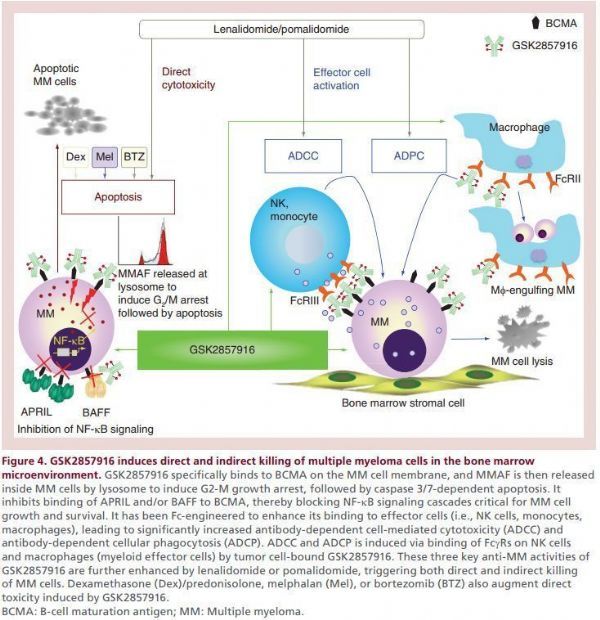
belantamab mafodotin作用機制
DREAMM臨床開發項目共包括10項臨床研究(DREAMM-1至DREAMM-10),正在評估Blenrep作為單藥療法以及用于組合療法一線、二線及多線治療MM的療效和安全性。之前公布的來自首個人體臨床研究DREAMM-1的更新數據顯示,在BCMA陽性R/R MM患者中,Blenrep治療的總緩解率(ORR)達到了60%。
在今年5月底召開的美國臨床腫瘤學會(ASCO)年會上,GSK還公布了DREAMM-6研究的數據。該研究在接受一種或多種療法難治或治療后病情復發的R/R MM患者中開展,調查了Blenrep(2.5mg/kg,Q3W)聯合硼替佐米/地塞米松(BorDex)的療效和安全性。
初步結果顯示,Blenrep聯合BorDex(B-Vd)治療的總緩解率(ORR)達到了78%(n=14/18;95%CI:52.4-93.6),50%為非常好的部分緩解(VGPR)、28%為部分緩解(PR)。獲得臨床受益(最小緩解或更好)的患者比例為83%(95%CI:58.6-96.4)。中位治療18.2周時,中位DoR尚未達到。3級或以上不良事件包括角膜病變(MEC;56%)和血小板減少(61%)。無4級MEC病例。這些初步結果,證實了Blenrep聯合治療在多發性骨髓瘤早期患者中的潛力。
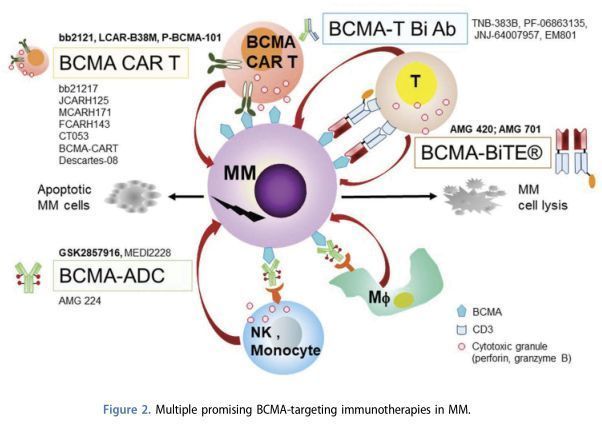
BCMA為靶點的在研MM免疫療法(來源文獻—PMID:31277554)
原文出處:European Commission approves BLENREP(belantamab mafodotin) for the treatment of patients with relapsed andrefractory multiple myeloma
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962
